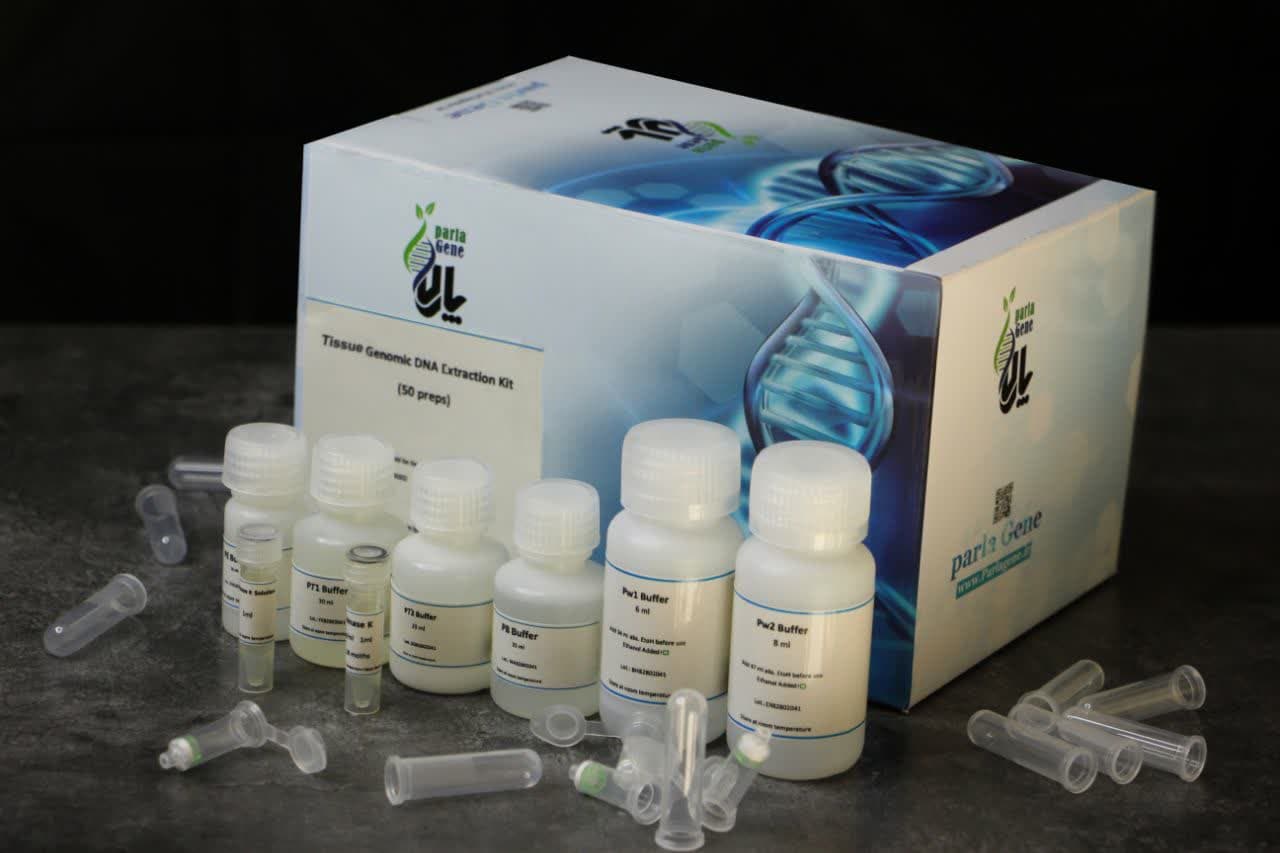
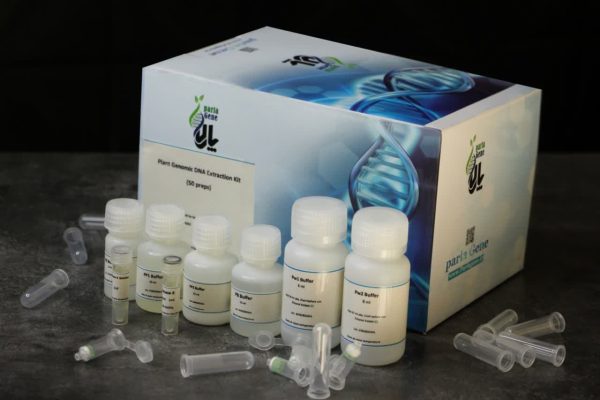
| 4 preps sample | 50 preps sample | 100 preps sample | |
| PT Buffer | 2ml | 20 ml | 40 ml |
| PB Buffer | 2.5ml | 25 ml | 50 ml |
| PW1 Buffer | 1.7ml | 6 ml | 6 ml x 2 |
| PW2 Buffer | 2ml | 8 ml | 8 ml x 2 |
| PE Buffer | 1.5ml | 10 ml | 20 ml |
| Proteinase K | 20 mg | 20 mg | 20 mg x 2 |
| Spin Column | Spin Column | 50 pcs | 50 pcs x 2 |
| Collection Tube | Collection Tube | 50 pcs | 50 pcs x 2 |
* آماده سازی بافر PW1 و PW2 و محلول پروتئیناز K قبل از اولین استفاده:
| 4 preps sample | 50 preps sample | 100 preps sample | |
| PW1 Buffer | 2ml x 2 | 40 ml | 40 ml x 2 |
| PW2 Buffer | 2.5ml | 55 ml | 55 ml x 2 |
| proteinase K | 100 μl | 1 ml | 1 ml x 2 |
قبل از اولین استفاده:
در کیت های 4 عددی
- مقدار ml7/1 اتانول (96-100) درصد به محلولPW1 Buffer و ml2 به محلول PW2 Buffer اضافه کنید و سپس لیبل روی ظرف ها را علامت گذاری کنید.
- قبل از اولین استفاده μl100 از محلول پروتئیناز K یا μl100از ddH2O را به ویال حاوی پروتئیناز K اضافه کنید و سپس به آرامی ویال را ورتکس کرده تا محلول به خوبی حل گردد.
در کیت های50 عددی
- مقدار ml34 اتانول (96-100) درصد به محلولPW1 Buffer و ml47 به محلول PW2 Buffer اضافه کنید و سپس لیبل روی ظرف ها را علامت گذاری کنید.
- قبل از اولین استفاده ml1 از محلول پروتئیناز K یا ml1 از ddH2O را به ویال حاوی پروتئیناز K اضافه کنید و سپس به آرامی ویال را ورتکس کرده تا محلول به خوبی حل گردد.
نکات مهم:
- ویال پروتئیناز K را در دمای -20°C نگهداری کنید. قبل از اولین استفاده حجم مورد نیاز محلول پروتئیناز K را به ویال پروتئیناز K اضافه کنید. سپس ورتکس کرده و مطمئن شوید که پروتئیناز K کاملاً حل شده است.
- حجم مورد نیاز اتانول (96-100) درصد را در اولین استفاده به بافر PW1 و بافر PW2 اضافه کنید.
- قبل از شروع استخراج انکوباسیون یا حمام آب را تا دمای °C 60 گرم کنید.
- قبل از شروع استخراج اتانول مطلق در دمای °C 20- ذخیره کنید.
روش استخراج:
- mg10-15 بافت را در یک میکروتیوب ml2 وزن کرده و μl 400 از محلول PT buffer به آن اضافه کنید. میکروتیوب را چند بار سروته کرده و بمدت چند ثانیه ورتکس کنید.
- μl 20 میکرولیتر پروتئیناز K به محلول اضافه کرده و بمدت 15 ثانیه بخوبی ورتكس کنید. سپس مخلوط حاصله را به مدت 30-20 دقیقه در دمای °C 60 انکوبه کنید. (در طی انکوباسیون، میکروتیوب هر چند دقیقه یکبار به آرامی تكان داده می شود تا لیز سلولی به خوبی صورت گیرد).
- پس از مدت زمان انکوباسیون روی محلول حاصله، μl 500 از محلول PB Buffer بریزید و به آرامی میکروتیوب را سر و ته کنید.( توجه کنید اگر پس از اضافه کردن PB Buffer داخل میکروتیوب رسوب بافت باقی ماند ، میکروتیوب را بمدت 2-1 دقیقه در دمای °C 60 انکوبه کنید تا بقیه رسوبات حل شوند).
- محلول حاصله را به ستون جداسازی که در داخل تیوب جمع کننده قرار دارد منتقل کنید و پس از آن در سانتریفیوژ با سرعت rpm 12000 بمدت 1 دقیقه قرار دهید.
- مایع جمع شده در تیوب جمع کننده را دور ریخته و ستون را مجددا در تیوب جمع کننده قرار دهید و از محلول PW1 buffer به میزان μl 700 به ستون اضافه کنید و آن را بمدت 2 دقیقه با سرعت rpm 10000 سانتریفیوژ کنید.
- پس از سانتریفیوژ مایع جمع شده در تیوب جمع کننده را دور ریخته و μl 500 از محلول PW2 buffe را به ستون اضافه کنید و آن را بمدت 2 دقیقه با سرعت rpm 10000 سانتریفیوژ کنید.
- ستون را مجددا در تیوب جمع کننده قرار دهید و بدون اضافه نمودن هیچ گونه محلولی آن را با سرعت rpm14000 بمدت 3 دقیقه سانتریفیوژکنید.
- ستون را به داخل یک میکروتیوب 5/1 میلی لیتری انتقال دهید و به مقدار μl 30 الی μl 100 از PE buffer اضافه کنید و بمدت 10-5 دقیقه در دمای اتاق انکوبه کنید.
- تیوب را بمدت 3 دقیقه با سرعت rpm 13000 سانتریفیوژ کنید، سپس ستون را دور انداخته و مایع جمع شده در میکروتیوب را که حاوی DNA است در دمای 20- درجه سانتیگراد نگهداری کنید.
توجه: برای حذف مقادیر احتمالی RNA ، μl 4 آنزیم RNase A با غلظت mg/ml10 ( از اجزای کیت نمی باشد) را در مرحله 2 قبل از اضافه کردن پروتئیناز K اضافه کنید و جند ثانیه ورتکس کرده، سپس مرحله 2 را ادامه دهید.